Deep Learning Enables Reduced Gadolinium Dose for Contrast-Enhanced Brain MRI (Journal of Magnetic Resonance Imaging 2018)
这是一篇医学图像增强的论文,介绍了研究人员正在使用人工智能来减少MRI检查后留在体内的造影剂的剂量。
提出背景
钆(gá,gadolinium)是一种用于对比材料的重金属,可增强MRI上的图像,作为一种纵向弛豫造影剂(T1制剂),其作用主要使T1缩短,在T1加权图像上呈高信号。研究发现,经过某些类型钆检查的人体内残留了大量的金属。这种沉积的影响尚不清楚,但放射科医师正在积极主动地优化患者安全性,同时保留钆增强MRI扫描提供的重要信息。因此,本文的目的就是提出一种基于深度学习的技术来降低钆剂量水平,同时保持全剂量对比度图像的质量和对比度信息。
本文的主要贡献:
① 用深度学习的方法来减少用于脑MRI检查的钆剂量,同时保持图像质量,避免对比度显著下降,这可能对患者有很大的好处。
② 定性和定量分析都表明所提出的深度学习方法与低剂量图像相比有显著的改进。此外,合成的全剂量增强MRI在运动伪影/混叠抑制方面与全剂量图像相比也有略微的改善,因为合成的全剂量图像是从具有较低峰值强度和较少运动伪影的图像中估计出来的。
数据集
在60例脑部MRI检查中,为每位患者收集了三组图像:造影前扫描,在造影剂施用前完成,称为零剂量扫描;低剂量扫描,在标准钆剂量给药10%后获得;和100%剂量给药后获得的全剂量扫描,如下: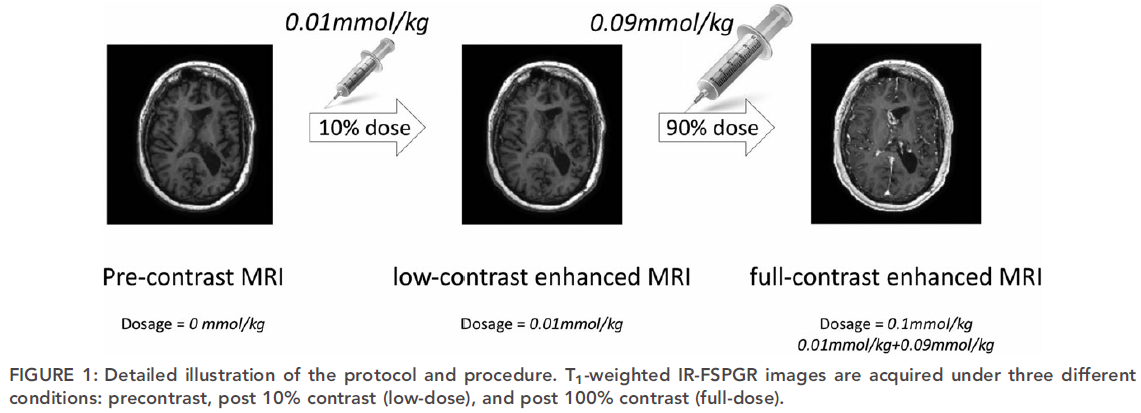
数据预处理
因为用于序列的发送和接收增益是由不同的预加值确定的,因此不能保证采集到的三组数据是相同的。因此要进行数据预处理。预处理步骤包括图像配准和信号归一化。其中,归一化是用来消除在不同剂量水平下获得的图像中的偏差,用非增强组织的掩膜来实现。具体过程如下: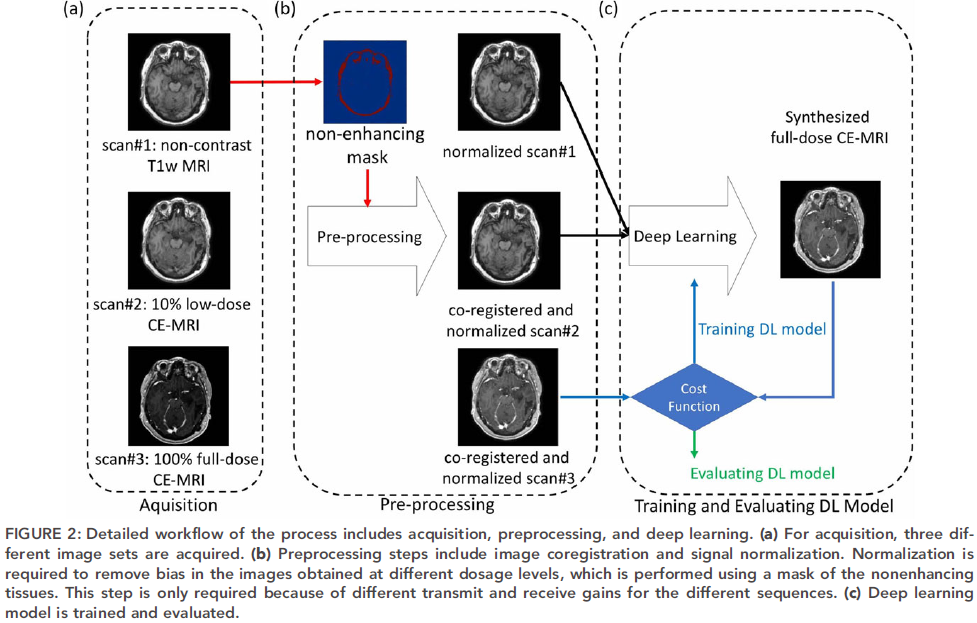
训练和测试
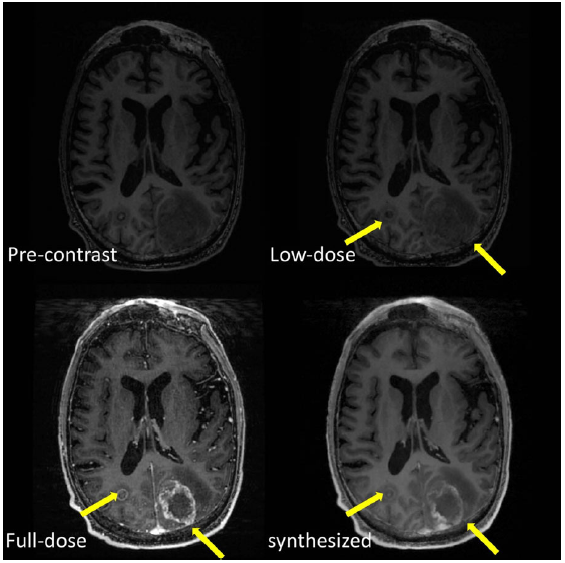
训练和测试是在配对和归一化之后进行的,基于这样的假设:低剂量CE-MRI和零剂量MRI的对比信号(剩余信号差异)是对齐且缩放的(scaled),但与全剂量CE-MRI和零剂量MRI的对比信号相比,具有更多噪声。这里其实就用到了残差的思想,从图上来看,网络就是用来学习noisy uptake与ref uptake的映射关系,最后再加上对比前的图就可以得到合成的全剂量图像。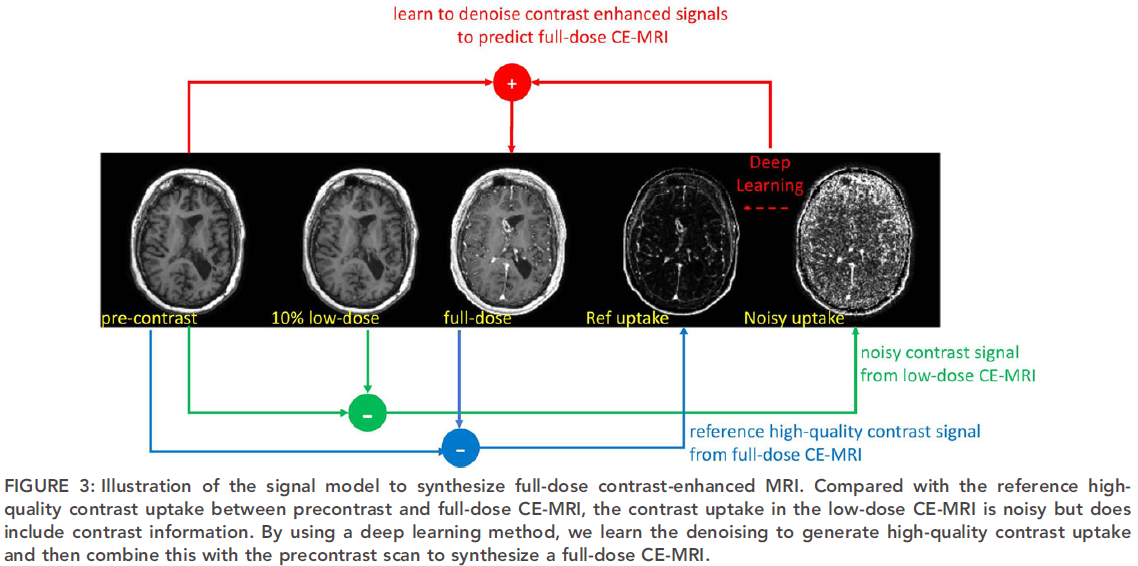
使用前10例(混合适应症)来训练模型,用零剂量和低剂量图像来接近全剂量图像。对于每个患者序列,从配准后的3Dvolumes中截取300-350个2D切片用于训练,但不包括所采集体积的底部五个切片和顶部五个切片,由于它们的信噪比(SNR)低。使用训练过的模型在两个测试集中创建合成的全剂量图像: 20例混合适应症患者和30例胶质瘤患者。测试的时候也是针对2D切片来做的,之后再把增强后的切片合成整个3Dvolume并保存为DICOM的形式用于验证。
网络结构
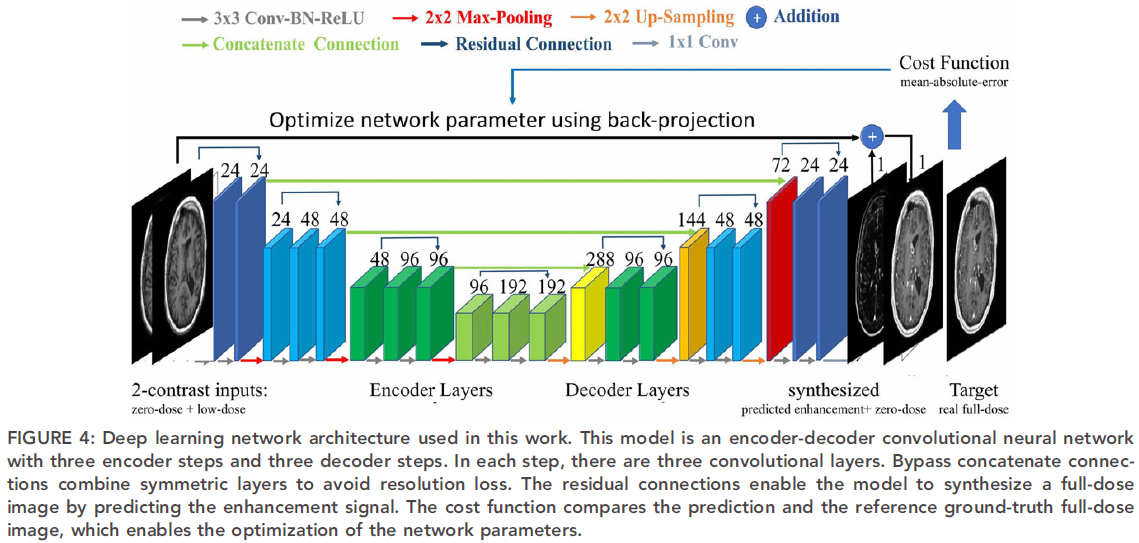
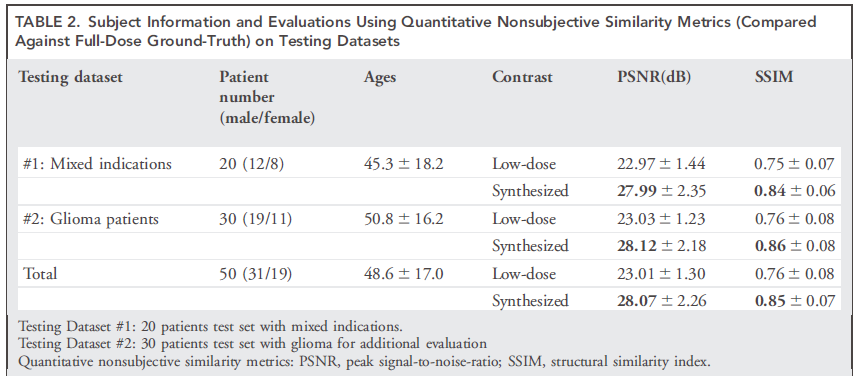
部分实验结果
局限性
文中,作者也给出了几个失败的案例,主要原因有两个,①在大脑基底附近的动脉中,真实的全剂量图像和合成的全剂量图像有很大的不同,这种差异是由于动脉流入效应(inflow effect)产生的非线性信号强度变化造成的,在较低的切片和对比度水平下的T1成像更明显;②次优的配准导致合成的全剂量图像出现假的对比度增强。结果如下: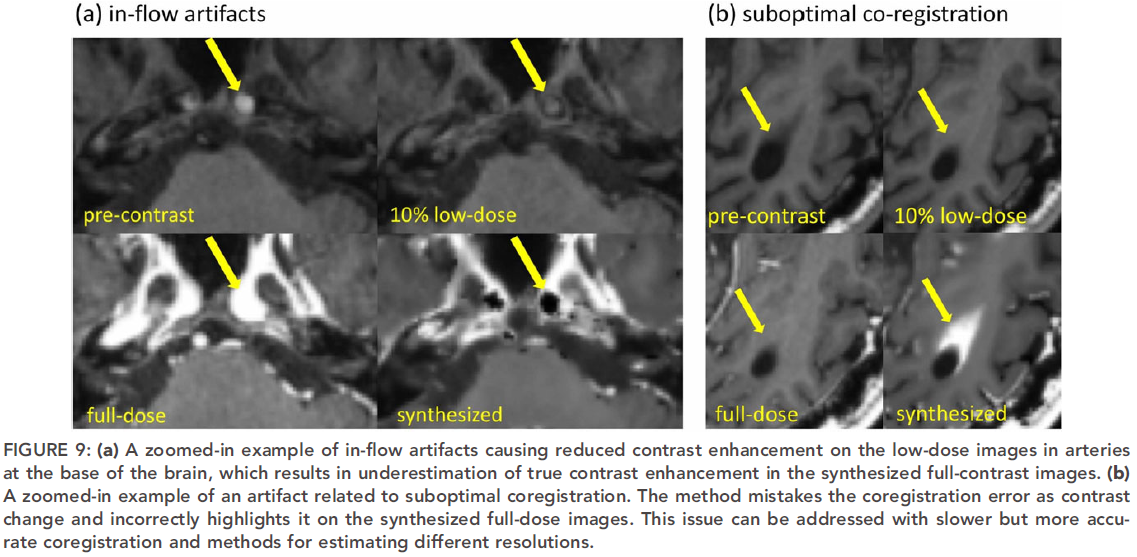
结论
该框架对钆剂量比通常使用的剂量减少90%的图像有明显的改善,在不牺牲诊断质量的情况下显着降低钆剂量,注意患者的安全。低剂量钆图像产生了大量尚未开发的临床有用信息,现在可通过深度学习和人工智能获取,研究人员已经证明这种方法在技术上是可行的,未来的研究将包括在更广泛的MRI扫描仪和不同类型的造影剂上评估算法。